אלקטרוליזה - עקרון הפעולה, המטרה והיישום
תהליכי אלקטרוליזה
 אלקטרוליזה נפוצה במטלורגיה לא-ברזלית ובמספר תעשיות כימיות. מתכות כגון אלומיניום, אבץ, מגנזיום מתקבלות בעיקר באלקטרוליזה. בנוסף, האלקטרוליזה משמשת לזיקוק (טיהור) נחושת, ניקל, עופרת, וכן לייצור מימן, חמצן, כלור ועוד מספר כימיקלים.
אלקטרוליזה נפוצה במטלורגיה לא-ברזלית ובמספר תעשיות כימיות. מתכות כגון אלומיניום, אבץ, מגנזיום מתקבלות בעיקר באלקטרוליזה. בנוסף, האלקטרוליזה משמשת לזיקוק (טיהור) נחושת, ניקל, עופרת, וכן לייצור מימן, חמצן, כלור ועוד מספר כימיקלים.
מהות האלקטרוליזה היא הפרדת חלקיקי החומר מהאלקטרוליט כאשר זרם ישר עובר דרך האמבט האלקטרוליטי והשקעתם על אלקטרודות הטבולות באמבטיה (אלקטרואקסטרקציה) או כאשר חומרים מועברים מאלקטרודה אחת דרך האלקטרוליט לאחרת ( זיקוק אלקטרוליטי). בשני המקרים, מטרת התהליכים היא להשיג את החומרים הטהורים ביותר האפשריים שאינם מזוהמים בזיהומים.
בניגוד מוליכות אלקטרונית מתכות באלקטרוליטים (תמיסות של מלחים, חומצות ובסיסים במים ובכמה ממסים אחרים, כמו גם בתרכובות מותכות), נצפית מוליכות יונית.
אלקטרוליטים הם מוליכים סוג ב'.בתמיסות ובהמסות אלו, מתרחשת ניתוק אלקטרוליטי - התפוררות של יונים בעלי מטען חיובי ושלילי.
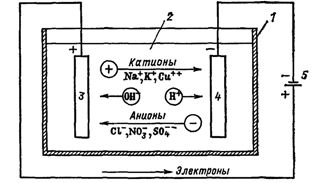
אם אלקטרודות המחוברות למקור אנרגיה חשמליות יוכנסו לכלי עם אלקטרוליט - אלקטרוליזר, אז יתחיל לזרום בו זרם יוני, ויונים בעלי מטען חיובי - יעברו לקתודה (אלה בעיקר מתכות ומימן ), ויונים בעלי מטען שלילי - אניונים (כלור, חמצן) - לאנודה.
באנודה, האניונים מוותרים על המטען שלהם והופכים לחלקיקים ניטרליים שמתמקמים על האלקטרודה. בקתודה, הקטיונים לוקחים אלקטרונים מהאלקטרודה וגם הם מנוטרלים, שוקעים עליה, והגזים המשתחררים על האלקטרודות בצורת בועות עולים למעלה.
אורז. 1. תהליכים בזמן אלקטרוליזה. מעגל אמבטיה חשמלי: 1 - אמבטיה, 2 - אלקטרוליט, 3 - אנודה, 4 - קתודה, 5 - ספק כוח
הזרם החשמלי במעגל החיצוני הוא תנועת אלקטרונים מהאנודה לקתודה (איור 1). במקרה זה התמיסה מתרוקנת, וכדי לשמור על רציפות תהליך האלקטרוליזה יש להעשיר אותה. כך מופקים חומרים מסוימים מהאלקטרוליט (אלקטרואקסטרקציה).

אם מניחים את האלקטרודה בתמיסה עם יונים מאותו חומר שממנו היא עשויה, אז בפוטנציאל מסוים בין האלקטרודה לתמיסה לא האלקטרודה מתמוססת וגם החומר מופקד עליה מהתמיסה.
פוטנציאל זה נקרא הפוטנציאל הנורמלי של החומר. אם פוטנציאל שלילי יותר מופעל על האלקטרודה, אז יתחיל שחרור של חומר (תהליך קתודי) עליו, אבל אם הוא חיובי יותר, אז יתחיל פירוק שלו (תהליך אנודי).
הערך של פוטנציאלים נורמליים תלוי בריכוז היונים ובטמפרטורה. מקובל להתייחס לפוטנציאל הנורמלי של מימן כאפס. טבלה 1 מציגה את פוטנציאל האלקטרודה הרגיל של כמה תמיסות מימיות של חומרים ב-+25 מעלות צלזיוס.
טבלה 1. פוטנציאלים תקינים של אלקטרודות ב-+25 מעלות צלזיוס
אם האלקטרוליט מכיל יונים של מתכות שונות, אז יונים עם פוטנציאל נורמלי שלילי נמוך יותר (נחושת, כסף, עופרת, ניקל) מופרדים תחילה בקתודה; מתכות אדמה אלקליין הן הקשות ביותר לבידוד. בנוסף, תמיד יש יוני מימן בתמיסות מימיות, שישתחררו מוקדם יותר מכל המתכות בעלות פוטנציאל נורמלי שלילי, לכן, במהלך האלקטרוליזה של האחרונות, מושקעת חלק ניכר או אפילו רוב האנרגיה בשחרור מימן. .
בעזרת אמצעים מיוחדים ניתן למנוע את התפתחות המימן בגבולות מסוימים, אך לא ניתן להשיג מתכות בעלות פוטנציאל תקין של פחות מ-1 V (לדוגמה, מגנזיום, אלומיניום, מתכות אדמה אלקליין) באלקטרוליזה מ- תמיסה מימית. הם מתקבלים על ידי פירוק של המלחים המותכים של מתכות אלה.
פוטנציאל אלקטרודה נורמלי של חומרים המצוינים בטבלה.1, הם מינימליים שבהם מתחיל תהליך האלקטרוליזה, בפועל נדרשים ערכים גדולים של הפוטנציאל לפיתוח התהליך.
ההבדל בין הפוטנציאל הממשי של אלקטרודה במהלך האלקטרוליזה לבין הפוטנציאל הרגיל שלה נקרא מתח יתר. זה מגביר את הפסדי האנרגיה במהלך אלקטרוליזה.
מצד שני, הגדלת מתח היתר ליוני מימן מקשה על שחרורו בקתודה, מה שמאפשר לקבל באלקטרוליזה מתמיסות מימיות מספר מתכות שליליות יותר ממימן כמו עופרת, בדיל, ניקל. , קובלט, כרום ואפילו אבץ. זה מושג על ידי ביצוע התהליך בצפיפות זרם מוגברת על האלקטרודות, כמו גם על ידי החדרת חומרים מסוימים לאלקטרוליט.
מהלך התגובות הקתודיות והאנודיות במהלך אלקטרוליזה נקבע על ידי שני החוקים הבאים של פאראדיי.
1. מסת החומר md המשתחררת במהלך האלקטרוליזה בקתודה או עוברת מהאנודה לאלקטרוליט היא פרופורציונלית לכמות החשמל המועברת דרך האלקטרוליט Azτ: me = α/τ, כאן a היא המקבילה האלקטרוכימית של החומר , g / C.
2. מסת החומר המשתחררת בזמן אלקטרוליזה עם אותה כמות חשמל עומדת ביחס ישר למסה האטומית של חומר A וביחס הפוך לערכיות שלו n: mNS = A / 96480n, כאן 96480 הוא מספר פאראדיי, C x mol -1 .
בדרך זו, המקבילה האלקטרוכימית של חומר α=A / 96480n מייצגת את המסה של חומר בגרמים המשתחררת מיחידת כמות חשמל העוברת באמבט האלקטרוליטי - קולומב (אמפר-שנייה).
עבור נחושת A = 63.54, n =2, α =63.54/96480-2= 0.000329 גרם / C, עבור ניקל α = 0.000304 גרם / C, עבור אבץ α = 0.00034 גרם / C

היחס בין מסת החומר המשתחרר בפועל למסה שלו שהייתה אמורה להשתחרר לפי חוק פאראדיי נקרא התפוקה הנוכחית של החומר η1.
לכן, עבור תהליך אמיתי mNS = η1 NS (A / 96480n) NS It
באופן טבעי, תמיד η1
יעילות הזרם תלויה באופן משמעותי בצפיפות הזרם של האלקטרודה. ככל שצפיפות זרם האלקטרודה עולה, יעילות הזרם עולה ויעילות התהליך עולה.
המתח Uel שיש לספק לאלקטרוליזר מורכב ממתח התפרקות Ep (הפרש פוטנציאלי של התגובות האנודיות והקתודיות), סכום מתחי היתר האנודיים והקתודיים, מפל המתח באלקטרוליט Ep, מפל המתח באלקטרוליט. Ue = IRep (Rep - התנגדות אלקטרוליטית), ירידת מתח בצמיגים, מגעים, אלקטרודות Uc = I(Rw +Rto +RNS). נקבל: Uel = Ep + Ep + Ue + Us.
ההספק הנצרך במהלך האלקטרוליזה שווה ל: Rel = IUmail = I(Ep + Ep + Ue + Uc)
מהכוח הזה, רק הרכיב הראשון משמש לביצוע תגובות, השאר הם הפסדי חום של התהליך. רק במהלך האלקטרוליזה של המלחים המותכים, נעשה שימוש שימושי בחלק מהחום המשתחרר באלקטרוליט IUe, שכן הוא מושקע בהמסת המלחים הטעונים באלקטרוליזר.
ניתן להעריך את היעילות של אמבט האלקטרוליזה לפי מסת החומר בגרמים המשתחררים לכל 1 J של חשמל שנצרך.ערך זה נקרא תפוקת האנרגיה של חומר. ניתן למצוא אותו על ידי הביטוי qe = (αη1) /Uel100, כאן α - שווה ערך אלקטרוכימי של חומר, g / C, η1 - פלט זרם, Uemail - מתח של אלקטרוליטי תא, V.