מהו הפוטנציאל של האלקטרודה
פוטנציאל אלקטרודה או פוטנציאל אלקטרודה של מתכת הוא הפרש פוטנציאל המתרחש בממשק מתכת-תמיסה כאשר מתכת שקועה בתמיסת אלקטרוליט כתוצאה מאינטראקציה של אטומי יוני מתכת על פני השטח הממוקמים בצמתים של סריג גביש עם קוטב מולקולות מים מכוונות לפני השטח של האלקטרודה ... זה נובע מהיווצרות של שכבה כפולה חשמלית, כלומר, התפלגות א-סימטרית של חלקיקים טעונים בגבול.
התופעה של פירוק מתכות באלקטרוליטים משמשת במקורות כימיים של חשמל. צלחת מתכת מעושנת בתמיסת מלח משלה, בדרך זו או אחרת, נוטה להתמוסס בה. נטייה זו נקראת לפעמים גמישות הפירוק של המתכת.
לוח אבץ טבול בתמיסת אבץ סולפט ZnTAKA4 נותנת חלקיקי אבץ לתמיסה בצורה של יונים טעונים חיובית.בשל העובדה שהאטומים הורודים עוזבים בצורה של יונים טעונים חיובית, נוצר עודף של אלקטרונים חופשיים על לוח האבץ והוא הופך למטען שלילי, ונוצר עודף של יונים חיוביים בשכבת הנוזל הסמוכה לפני השטח. של האבץ, ולפיכך שכבה זו נטענת בצורה חיובית. בדרך זו, נוצרת שכבה כפולה חשמלית של מטענים מופרדים במרחב של סימן הפוך בממשק שבין הנוזל למתכת.
מטענים אלו יתנגדו למעבר נוסף של המתכת לתמיסה - הלוחות השליליים מחזיקים את יון המתכת החיובי, והמטען החיובי של האלקטרוליט דוחף את יון המתכת בחזרה לכיוון הלוח. במילים אחרות, השדה החשמלי של השכבה הכפולה בממשק מתכת-נוזל נוגד את המעבר הנוסף של יוני מתכת לתמיסה. נוצר איזון בין כוחות הנטייה של המתכת להיכנס לתמיסה, כימי באופיים, ו הכוחות החשמליים שמנוגדים.
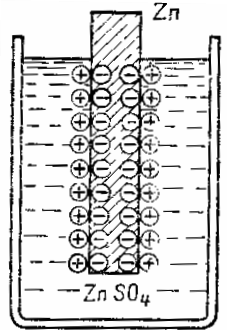
תרשים של היווצרות שכבה כפולה חשמלית בממשק בין מתכת לאלקטרוליט
כך, עקב פירוק באלקטרוליט, אלקטרודת המתכת רוכשת פוטנציאל מסוים של אלקטרודה (במילים אחרות, אלקטרוכימי) ביחס לאלקטרוליט, התלוי בחומר האלקטרודה ובהרכב האלקטרוליט.
עם זאת, פוטנציאל האלקטרודה יכול להיות חיובי. זה קורה במקרים שבהם היונים החיוביים של התמיסה עוברים לאלקטרודה, מטעינים אותה בצורה חיובית, ושכבת האלקטרוליט - שלילי, למשל, כאשר צלחת נחושת טבולה בתמיסה מרוכזת מספיק של נחושת גופרתית (CuSO)4).
ניתן לדמות את השכבה הכפולה החשמלית לקבל, שאחד הלוחות שלו הוא משטח המתכת והשני הוא שכבת יונים בתמיסה על פני המתכת. בין הלוחות הטעונים הפוך ויש הבדל, או קפיצה, בפוטנציאל.
קפיצת הפוטנציאל בממשק אלקטרודה-פתרון יכולה לשמש כמדד ליכולת החיזור של המערכת. עם זאת, אי אפשר למדוד קפיצה פוטנציאלית כזו או, באופן שווה ערך, את הפרש הפוטנציאל בין שני השלבים. אבל אתה יכול למדוד ה. וכו ' ג אלמנטים המורכבים מהאלקטרודות שאנו מעוניינים בהן ומאיזו אלקטרודה אחת (זהה בכל המקרים), שהפוטנציאל שלה מותנה בהנחה שהוא אפס.
זה נמדד וכו'. ג יאפיין את יכולת החיזור של האלקטרודה שאנו מעוניינים בה ביחס לאפס מותנה כלשהו. הערך המתקבל כך נקרא הפוטנציאל הפנימי של המתכת.
כדי למדוד את פוטנציאל האלקטרודה של כל מתכת, יש צורך למקם אלקטרודה שנייה באלקטרוליט, אשר בתורה תהיה בעלת פוטנציאל אלקטרודה מסוים, בהתאם לחומר שלה. לכן, ניתן למדוד ישירות את הסכום האלגברי של שני פוטנציאלים של אלקטרודות.
מסיבה זו, פוטנציאל האלקטרודה של חומרים שונים נקבעים ביחס לתקן (אלקטרודת מימן, שהפוטנציאל שלה בדרך כלל נחשב לאפס.
ניתן להשתמש גם באלקטרודות ייחוס אחרות שהפוטנציאל שלהן ביחס לאלקטרודת סטנדרט המימן ידועה למדידה. פוטנציאל זה נמצא גם על סמך מדידה של e. וכו ' ג מעגל המורכב מאלקטרודת ייחוס נבחרת ואלקטרודת מימן רגילה.
אם האלקטרודה הנחקרת המחוברת לאלקטרודת מימן סטנדרטית היא שלילית, הסימן » -» מוקצה לפוטנציאל הפנימי, אחרת, הסימן «+».
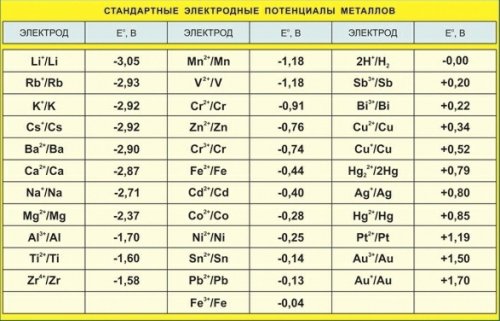
לדוגמה, פוטנציאל האלקטרודה של אבץ -0.76 וולט, נחושת +0.34 וולט, כסף +0.8 וולט, הנמדד בצורה זו בתמיסה של מלח המתכת המתאים, נקבע על ידי הפחתת הפוטנציאל השלילי יותר מהפוטנציאל ב--חיובי.
אם מניחים שני לוחות מתכת בעלי פוטנציאל אלקטרודה שונה באלקטרוליט המתאים, למשל, בתמיסה של חומצה גופרתית (H2SO4) שמונחים אבץ (Zn) ונחושת (Cth), אז מד מתח המחובר ללוחות אלו יראה מתח בין הם מעט יותר מ-1 V.
המתח הזה, במקרה זה נקרא e. וכו ' ג זוג גלווני, יהיה בשל ההבדל בפוטנציאל האלקטרודה של נחושת, בעלת פוטנציאל חיובי קטן, ואבץ, בעל פוטנציאל שלילי משמעותי. מכשיר כזה הוא התא הגלווני הפשוט ביותר - תא וולטה.
בתא גלווני מומרת אנרגיה כימית לאנרגיה חשמלית ובעזרתה ניתן לבצע עבודות חשמליות עקב אנרגיה של תגובה כימית.
מדידה של ה. וכו ' ג. יש לייצר תאים גלווניים בהיעדר זרם במעגל התא. אחרת, ה-e הנמדד. וכו ' s. יהיה קטן מהערך המוגדר כ ההבדל בין פוטנציאל שיווי המשקל של שתי האלקטרודות... למעשה, ריכוז מסוים של אלקטרונים על האלקטרודות מתאים לפוטנציאל שיווי המשקל: ככל שהוא חיובי יותר, כך הוא שלילי יותר. בהתאם, גם המבנה של אותו חלק בשכבה הכפולה שנמצא בתמיסה שונה.
מדידה של ה. וכו ' עםתא ללא זרימת זרם מיוצר בדרך כלל בשיטת הפיצוי. כדי ליישם את זה, אתה צריך כמה סטנדרטי וכו'. עם האלמנט הרגיל כביכול משמש כתקן כזה. לרוב הם משתמשים באלמנט הרגיל של כספית-קדמיום של ווסטון, למשל. וכו ' עם ששווה ל-1.01830 וולט ב-20 מעלות צלזיוס.