איך סוללות עובדות ועובדות
 במובן הרחב של המילה בטכנולוגיה, המונח "סוללה" מתייחס למכשיר המאפשר בתנאי הפעלה מסוימים לצבור סוג מסוים של אנרגיה, ובאחרים להשתמש בה לצרכי האדם.
במובן הרחב של המילה בטכנולוגיה, המונח "סוללה" מתייחס למכשיר המאפשר בתנאי הפעלה מסוימים לצבור סוג מסוים של אנרגיה, ובאחרים להשתמש בה לצרכי האדם.
הם משמשים במקום שבו יש צורך לאסוף אנרגיה לזמן מסוים ולאחר מכן להשתמש בה לביצוע תהליכים עתירי עבודה גדולים. לדוגמה, מצברים הידראוליים המשמשים במנעולים מאפשרים לספינות לעלות לרמה חדשה על אפיק הנהר.
סוללות חשמליות פועלות עם חשמל על אותו עיקרון: ראשית, הן צוברות (צוברות) חשמל ממקור טעינה חיצוני ולאחר מכן נותנות אותו לצרכנים המחוברים לבצע עבודה. מטבעם, הם שייכים למקורות זרם כימיים המסוגלים לבצע מחזורים תקופתיים של פריקה וטעינה שוב ושוב.
במהלך הפעולה מתרחשות כל הזמן תגובות כימיות בין מרכיבי לוחות האלקטרודה עם חומר המילוי שלהם - אלקטרוליט.
תרשים סכמטי של מכשיר סוללה יכול להיות מיוצג על ידי ציור פשוט כאשר שתי לוחות של מתכות שונות עם חוטים מוכנסים לגוף הכלי כדי לספק מגעים חשמליים. אלקטרוליט נשפך בין הלוחות.
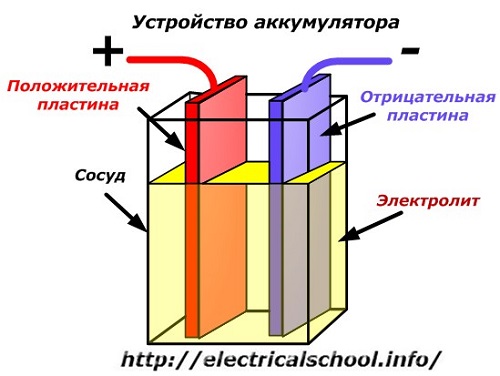
פעולת סוללה בעת פריקה
כאשר עומס, כמו נורה, מחובר לאלקטרודות, נוצר מעגל חשמלי סגור שדרכו זורם זרם הפריקה. הוא נוצר על ידי תנועה של אלקטרונים בחלקי מתכת ואניונים עם קטיונים באלקטרוליט.
תהליך זה מוצג באופן קונבנציונלי על דיאגרמה עם עיצוב אלקטרודה ניקל-קדמיום.
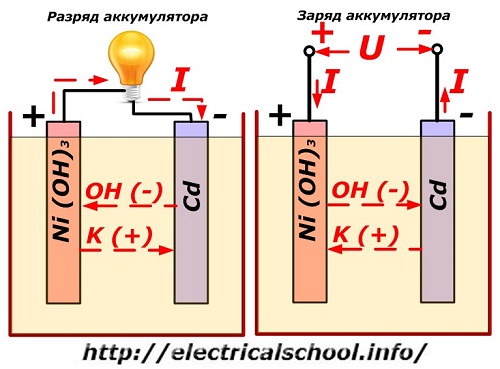
כאן, תחמוצות ניקל עם תוספים גרפיט, אשר מגבירים מוליכות חשמלית, משמשים כחומר של האלקטרודה החיובית. המתכת של האלקטרודה השלילית היא קדמיום ספוגי.
במהלך הפריקה, חלקיקי חמצן פעילים מתחמוצות ניקל משתחררים אל האלקטרוליט ומופנים אל הלוחות השליליים, שם מתחמצן הקדמיום.
ביצועי הסוללה בעת טעינה
כאשר העומס כבוי, מתח קבוע (במצבים מסוימים, פועם) מופעל על מסופי הלוח בעל ערך גבוה מזה של סוללה טעונה באותה קוטביות, כאשר מסופי הפלוס והמינוס של המקור והצרכן חופפים. .
למטען תמיד יש יותר כוח, מה ש"מדכא" את האנרגיה השיורית בסוללה ויוצר זרם חשמלי בכיוון ההפוך לפריקה. כתוצאה מכך משתנים התהליכים הכימיים הפנימיים בין האלקטרודות לאלקטרוליט. לדוגמה, על קופסה של לוחות ניקל-קדמיום, האלקטרודה החיובית מועשרת בחמצן, והשלילית - למצב של קדמיום טהור.
כאשר הסוללה מתרוקנת וטעונה, ההרכב הכימי של חומר הלוחות (אלקטרודות) משתנה, אך האלקטרוליט אינו משתנה.
שיטות חיבור סוללה
חיבור מקביל
כמות זרם הפריקה שאדם יכול לעמוד בו תלויה בגורמים רבים, אך בעיקר בעיצוב, בחומרים המשמשים ובמידותיהם. ככל ששטח הלוחות באלקטרודות גדול יותר, כך הם יכולים לעמוד בזרם גדול יותר.
עיקרון זה משמש לחיבור תאים מאותו סוג במקביל בסוללות כאשר יש צורך להגדיל את הזרם לעומס.אבל כדי לטעון עיצוב כזה, יהיה צורך להגדיל את הספק של המקור. שיטה זו משמשת לעתים רחוקות עבור מבנים מוכנים, שכן עכשיו זה הרבה יותר קל לרכוש מיד את הסוללה הדרושה. אבל יצרני סוללות חומצה משתמשים בו, ומחברים צלחות שונות לבלוקים בודדים.
חיבור טורי
בהתאם לחומרים המשמשים, ניתן ליצור מתח של 1.2 / 1.5 או 2.0 וולט בין שתי לוחות האלקטרודות של הסוללות הנפוצות בחיי היומיום. (למעשה, טווח זה הוא הרבה יותר רחב.) ברור שזה לא מספיק עבור מכשירים חשמליים רבים. לכן, סוללות מאותו סוג מחוברות בסדרה, ולרוב זה נעשה במקרה אחד.
דוגמה לעיצוב כזה היא פיתוח רכב נרחב המבוסס על לוחות חומצה גופרתית ואלקטרודות עופרת.
בדרך כלל, בקרב אנשים, בעיקר בקרב נהגי הובלה, נהוג לקרוא לכל מכשיר סוללה, ללא קשר למספר המרכיבים המרכיבים אותו - קופסאות. עם זאת, זה לא לגמרי נכון.המבנה, המורכב ממספר קופסאות המחוברות בסדרה, הוא כבר סוללה, שעליה מודבק השם המקוצר «АКБ»... המבנה הפנימי שלה מוצג באיור.
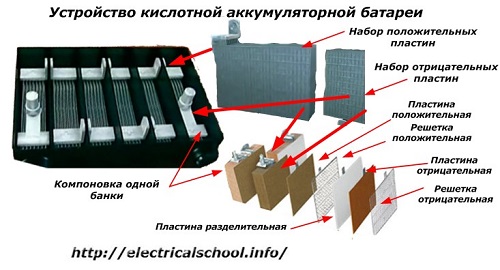
כל אחת מהצנצנות מורכבת משני בלוקים עם סט לוחות עבור האלקטרודות החיוביות והשליליות. הבלוקים משתלבים זה בזה ללא מגע מתכתי עם אפשרות לחיבור גלווני אמין דרך האלקטרוליט.
במקרה זה, ללוחות המגע יש רשת נוספת והם מופרדים זה מזה על ידי לוח מפריד.
חיבור הלוחות בבלוקים מגדיל את שטח העבודה שלהם, מפחית את ההתנגדות הכוללת של המבנה כולו ומאפשר לך להגדיל את כוחו של העומס המחובר.
בצד החיצוני של הקופסה, לסוללה כזו יש את האלמנטים המוצגים באיור למטה.
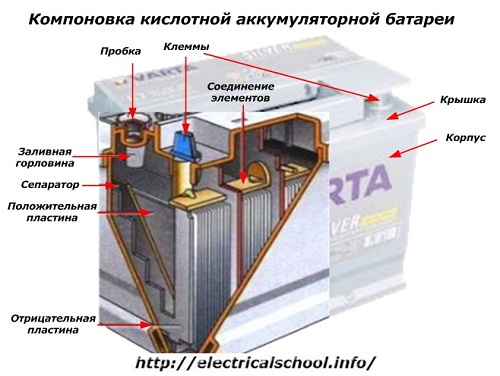
הוא מראה כי בית הפלסטיק החזק אטום בכיסוי ומצויד בשני חיבורים (בדרך כלל בצורת חרוט) מלמעלה לחיבור למעגל החשמלי של המכונית. סימוני קוטביות מוטבעים על המסופים שלהם: «+» ו-«-«. בדרך כלל למסוף החיובי יש קוטר קצת יותר גדול מהמסוף השלילי כדי לחסום שגיאות חיווט.
לסוללות שניתן לטפל בהן יש חור מילוי בחלק העליון של כל צנצנת כדי לשלוט ברמת האלקטרוליט או להוסיף מים מזוקקים במהלך הפעולה. מוברג לתוכו תקע, המגן על החללים הפנימיים של המארז מפני זיהום ובמקביל מונע מהאלקטרוליט להישפך בעת הטיית הסוללה.
מכיוון שבטעינה חזקה מתאפשרת גז מהאלקטרוליט (ותהליך זה אפשרי בנהיגה אינטנסיבית), נוצרים חורים בפקק כדי למנוע מהלחץ בתוך הקופסה להגדיל.חמצן ומימן, כמו גם אדי אלקטרוליטים, יוצאים דרכם. מומלץ להימנע ממצבים כאלה הכוללים זרמי טעינה מוגזמים.
אותה איור מציגה את חיבור האלמנטים בין הגדות ואת סידור לוחות האלקטרודות.
סוללות מתנע לרכב (חומצת עופרת) פועלות על עיקרון של סולפטציה כפולה. בזמן פריקה/טעינה מתרחש עליהם תהליך אלקטרוכימי המלווה בשינוי בהרכב הכימי של המסה הפעילה של האלקטרודות עם שחרור/ספיגה של מים באלקטרוליט (חומצה גופרתית).
זה מסביר את העלייה במשקל הסגולי של האלקטרוליט בעת הטעינה והירידה כשהסוללה מתרוקנת. במילים אחרות, ערך הצפיפות מאפשר לך להעריך את המצב החשמלי של הסוללה. מכשיר מיוחד משמש למדידתו - הידרומטר לרכב.
מים מזוקקים, המהווים חלק מהאלקטרוליט של סוללות חומצה, הופכים למצב מוצק - קרח בטמפרטורות שליליות. לכן, על מנת למנוע קפואה של מצברי רכב במזג אוויר קר, יש צורך להפעיל אמצעים מיוחדים הקבועים בכללים לניצול.
אילו סוגי סוללות קיימים?
ייצור מודרני למטרות שונות מייצר יותר משלושה תריסר מוצרים עם הרכב שונה של אלקטרודות ואלקטרוליט. 12 דגמים ידועים פועלים על ליתיום בלבד.

ניתן למצוא את הדברים הבאים כמתכת אלקטרודה:
-
עוֹפֶרֶת;
-
בַּרזֶל;
-
לִיתִיוּם;
-
טִיטָן;
-
קובלט;
-
קדמיום;
-
ניקל;
-
אָבָץ;
-
כסף;
-
ונדיום;
-
אֲלוּמִינְיוּם
-
כמה פריטים אחרים.
הם משפיעים על מאפייני הפלט החשמלי ולכן על היישום.
היכולת לעמוד בעומסים גבוהים לטווח קצר הנובעים מסיבוב גל הארכובה של מנועי בעירה פנימית על ידי מנועי מתנע חשמליים אופיינית לסוללות עופרת. הם נמצאים בשימוש נרחב בתחבורה, אל פסק ומערכות חשמל חירום.
תֶקֶן תאים גלווניים (סוללות רגילות) מוחלפות בדרך כלל בסוללות ניקל-קדמיום, ניקל-אבץ וניקל-מתכת הידריד.
אבל עיצובי ליתיום-יון או ליתיום-פולימר פועלים בצורה מהימנה במכשירים ניידים ומחשוב, כלי בנייה ואפילו כלי רכב חשמליים.
בהתאם לסוג האלקטרוליט המשמש, הסוללות הן:
-
חָמוּץ
-
בְּסִיסִי.
יש סיווג של סוללות לפי ייעוד. לדוגמה, בתנאים מודרניים, הופיעו מכשירים המשמשים להעברת אנרגיה - טעינת מקורות אחרים. הסוללה החיצונית כביכול עוזרת לבעלים של מכשירים ניידים רבים בהיעדר רשת חשמל מתחלפת. הוא מסוגל לטעון שוב ושוב טאבלט, סמארטפון, טלפון נייד.
לכל הסוללות הללו יש את אותו עיקרון פעולה ומכשיר דומה. לדוגמה, דגם אצבע הליתיום-יון המוצג באיור למטה חוזר במובנים רבים על העיצוב של סוללות החומצה שנדונו קודם לכן.
כאן אנו רואים את אותן אלקטרודות מגע, לוחות, מפריד ודיור. רק הם נעשים תוך התחשבות בתנאי עבודה אחרים.
מאפיינים חשמליים בסיסיים של סוללה
פעולת המכשיר מושפעת מהפרמטרים:
-
קיבולת;
-
צפיפות אנרגיה;
-
פריקה עצמית;
-
משטר טמפרטורה.
הקיבולת נקראת המטען המקסימלי של הסוללה, שהיא מסוגלת לתת במהלך הפריקה למתח הנמוך ביותר. זה מתבטא בתליונים (מערכת SI) ובאמפר-שעה (יחידה שאינה מערכתית).
כסוג של קיבולת יש "קיבולת אנרגיה", הקובעת את האנרגיה המשתחררת במהלך הפריקה למתח המינימלי המותר. הוא נמדד בג'אול (SI) ובוואט-שעה (יחידות שאינן SI).
צפיפות האנרגיה מתבטאת כיחס בין כמות האנרגיה למשקל או לנפח הסוללה.
פריקה עצמית שקול את אובדן הקיבולת לאחר טעינה בהיעדר עומס על המסופים. זה תלוי בתכנון ומחמיר על ידי תקלות בידוד בין האלקטרודות מסיבות רבות.
טמפרטורת ההפעלה משפיעה על המאפיינים החשמליים ובמקרה של חריגות חמורות מהנורמה שצוינה על ידי היצרן, היא עלולה להזיק לסוללה. חום וקור אינם מקובלים, הם משפיעים על מהלך התגובות הכימיות ועל לחץ הסביבה בתוך הקופסה.
