זרם חשמלי באלקטרוליטים
זרם חשמלי באלקטרוליטים קשור תמיד להעברת החומר. במתכות ובמוליכים למחצה, למשל, החומר כאשר זרם עובר דרכם אינו מועבר, כי במדיה אלו אלקטרונים וחורים הם נושאי זרם, אך באלקטרוליטים הם מועברים. הסיבה לכך היא שבאלקטרוליטים, היונים בעלי המטען החיובי והשלילי של החומר פועלים כנשאים של מטענים חופשיים, לא אלקטרונים או חורים כלל.
תרכובות מותכות של מתכות רבות, כמו גם כמה מוצקים, שייכות לאלקטרוליטים. אבל הנציגים העיקריים של סוג זה של מוליכים, הנמצאים בשימוש נרחב בטכנולוגיה, הם תמיסות מימיות של חומצות אנאורגניות, בסיסים ומלחים.
החומר, כאשר זרם חשמלי עובר בתווך האלקטרוליט, משתחרר על האלקטרודות. תופעה זו נקראת הַפרָדָה חַשְׁמָלִית... כאשר זרם חשמלי עובר דרך האלקטרוליט, היונים הטעונים בחיוב ושלילי של החומר נעים בו זמנית בכיוונים מנוגדים.
יונים בעלי מטען שלילי (אניונים) ממהרים אל האלקטרודה החיובית של מקור הזרם (אנודה), ויונים טעונים חיובית (קטיונים) אל הקוטב השלילי שלה (קתודה).
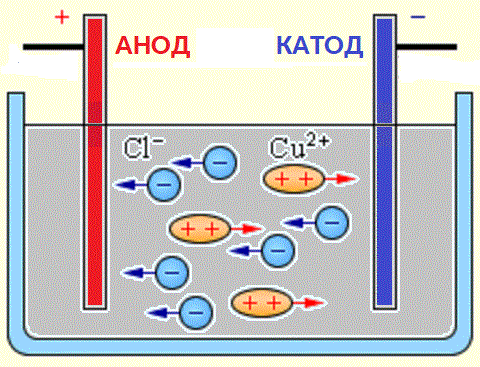
מקורות של יונים בתמיסות מימיות של חומצות, בסיסים ומלחים הם מולקולות ניטרליות, שחלקן מתפצלות בפעולת כוח חשמלי המופעל. תופעה זו של פיצול מולקולות ניטרליות נקראת דיסוציאציה אלקטרוליטית. לדוגמה, נחושת כלוריד CuCl2 מתפרק עם פירוק בתמיסה מימית ליוני כלוריד (טעון שלילי) ונחושת (טעינה חיובית).
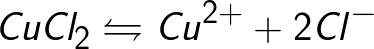
כאשר האלקטרודות מחוברות למקור זרם, השדה החשמלי מתחיל לפעול על יונים בתמיסה או להתמוסס, כאשר אניוני כלור עוברים לאנודה (אלקטרודה חיובית) וקטיוני נחושת לקתודה (אלקטרודה שלילית).
בהגיעם לאלקטרודה השלילית, יוני הנחושת הטעונים חיובית מנוטרלים על ידי עודפי האלקטרונים בקתודה והופכים לאטומים ניטרליים המופקדים על הקתודה. בהגיעם לאלקטרודה החיובית, יוני הכלור הטעונים שלילי תורמים אלקטרון אחד כל אחד במהלך האינטראקציה עם המטען החיובי על האנודה. במקרה זה, אטומי הכלור הניטרליים שנוצרו מתאחדים בזוגות ויוצרים מולקולות Cl2, והכלור משתחרר בצורה של בועות גז באנודה.
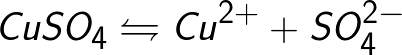
לעתים קרובות, תהליך האלקטרוליזה מלווה באינטראקציה של תוצרי דיסוציאציה (זה נקרא תגובות משניות), כאשר תוצרי הפירוק המשתחררים על האלקטרודות מתקשרים עם הממס או ישירות עם חומר האלקטרודה. קחו, למשל, את האלקטרוליזה של תמיסה מימית של נחושת גופרתית (סולפט נחושת - CuSO4).בדוגמה זו, האלקטרודות יהיו עשויות נחושת.
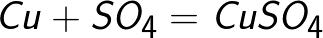
מולקולת הגופרית הנחושת מתנתקת ליצירת יון נחושת טעון חיובי Cu + ויון גופרתי טעון שלילי SO4-. אטומי נחושת ניטרליים מופקדים כמשקע מוצק על הקתודה. בדרך זו מתקבלת נחושת טהורה מבחינה כימית.
יון הסולפט תורם שני אלקטרונים לאלקטרודה החיובית והופך לרדיקל הנייטרלי SO4, המגיב מיד עם אנודת הנחושת (תגובת האנודה המשנית). תוצר התגובה באנודה הוא נחושת גופרתית, אשר נכנס לתמיסה.
מסתבר שכאשר עובר זרם חשמלי בתמיסה מימית של גופרת נחושת, אנודת הנחושת פשוט מתמוססת בהדרגה ונחושת משקעת על הקתודה.במקרה זה, ריכוז התמיסה המימית של גופרת נחושת אינו משתנה.
בשנת 1833, הפיזיקאי האנגלי מייקל פאראדיי, במהלך עבודת ניסוי, קבע את חוק האלקטרוליזה, שנקרא כיום על שמו.
חוק פאראדיי מאפשר לקבוע את כמות המוצרים העיקריים המשתחררים על האלקטרודות במהלך האלקטרוליזה. החוק קובע את הדברים הבאים: "מסה m של החומר המשתחררת על האלקטרודה בזמן האלקטרוליזה עומדת ביחס ישר למטען Q שעבר דרך האלקטרוליט".
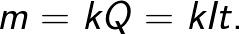
גורם המידתיות k בנוסחה זו נקרא המקבילה האלקטרוכימית.
מסת החומר המשתחררת על האלקטרודה במהלך האלקטרוליזה שווה למסה הכוללת של כל היונים שהגיעו לאלקטרודה זו:
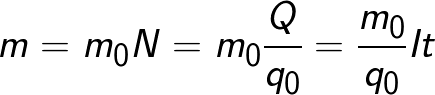
הנוסחה מכילה את המטען q0 ואת המסה m0 של יון, וכן את המטען Q שעבר דרך האלקטרוליט. N הוא מספר היונים שהגיעו לאלקטרודה כאשר המטען Q עבר דרך האלקטרוליט.לכן, היחס בין המסה של היון m0 למטען שלו q0 נקרא המקבילה האלקטרוכימית של k.
מכיוון שהמטען של יון שווה מספרית למכפלת הערכיות של החומר והמטען היסודי, ניתן לייצג את המקבילה הכימית בצורה הבאה:
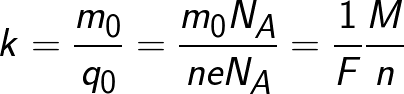
איפה: Na הוא הקבוע של אבוגדרו, M הוא המסה המולרית של החומר, F הוא הקבוע של פאראדיי.
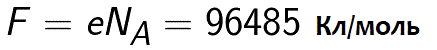
למעשה, ניתן להגדיר את קבוע פאראדיי ככמות המטען שצריכה לעבור דרך האלקטרוליט כדי לשחרר שומה אחת של חומר חד ערכי על האלקטרודה. חוק האלקטרוליזה של פאראדיי מקבל אז את הצורה:
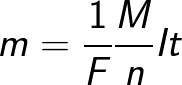
תופעת האלקטרוליזה נמצאת בשימוש נרחב בייצור מודרני. לדוגמה, אלומיניום, נחושת, מימן, מנגן דו חמצני ומי חמצן מיוצרים באופן תעשייתי על ידי אלקטרוליזה. מתכות רבות מופקות מעפרות ומעובדות על ידי אלקטרוליזה (זיקוק אלקטרו ומיצוי אלקטרו).
כמו כן, הודות לאלקטרוליזה, מקורות זרם כימיים... אלקטרוליזה משמשת לטיפול בשפכים (חילוץ אלקטרו, קרישה אלקטרו, אלקטרופלוטציה). חומרים רבים (מתכות, מימן, כלור וכו') מתקבלים באלקטרוליזה לציפוי אלקטרוני ולציפוי אלקטרוני.
ראה גם:ייצור מימן על ידי אלקטרוליזה של מים - טכנולוגיה וציוד

